背景と研究デザイン
レタトルチド(LY3437943)は、活性化する新規単一ペプチド薬である。3つの受容体を同時にGIP、GLP-1、グルカゴン。糖尿病のない肥満患者における有効性と安全性を評価するために、第2相ランダム化二重盲検プラセボ対照試験が実施された(NCT04881760)。338人の参加者BMIが30以上の患者、またはBMIが27以上で少なくとも1つの体重関連合併症がある患者を、プラセボまたはレタトルチド(1mg、2段階の漸増スケジュールによる4mg、2段階の漸増スケジュールによる8mg、または12mg)を週1回皮下注射で48週間投与する群に無作為に割り付けた。主要評価項目24週時点での体重の変化率であり、副次的評価項目には48週時点での体重の変化とカテゴリ別体重減少閾値(≥5%、≥10%、≥15%)が含まれていました。
主な結果
-
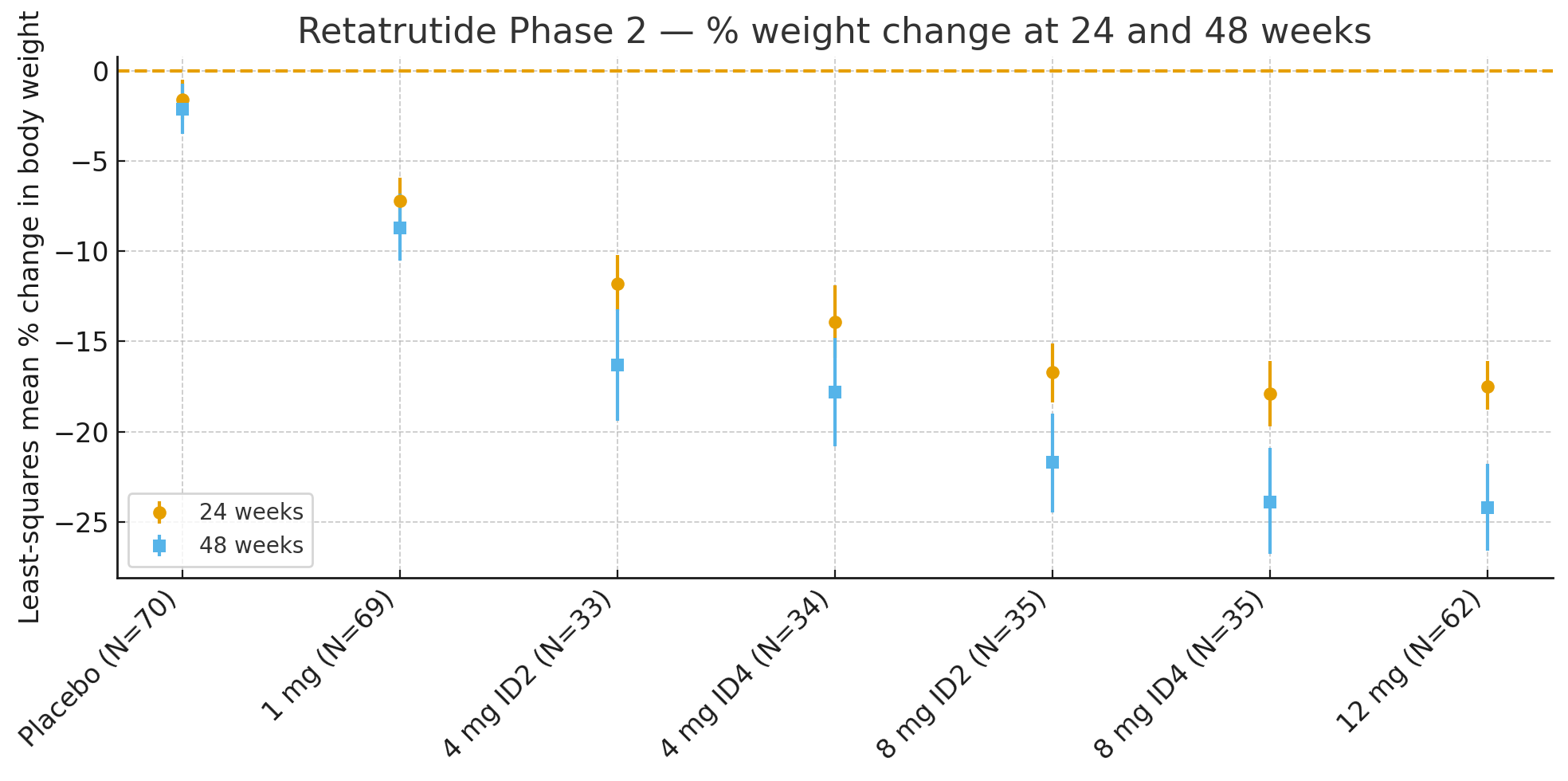
24週間: ベースラインと比較した体重の最小二乗平均パーセント変化は
-
プラセボ:−1.6%
-
1mg:−7.2%
-
4mg(合計):−12.9%
-
8mg(合計):−17.3%
-
12mg:−17.5%
-
-
48週間: 体重の変化率は
-
プラセボ:−2.1%
-
1mg:−8.7%
-
4mg(合計):−17.1%
-
8mg(合計):−22.8%
-
12mg:−24.2%
-
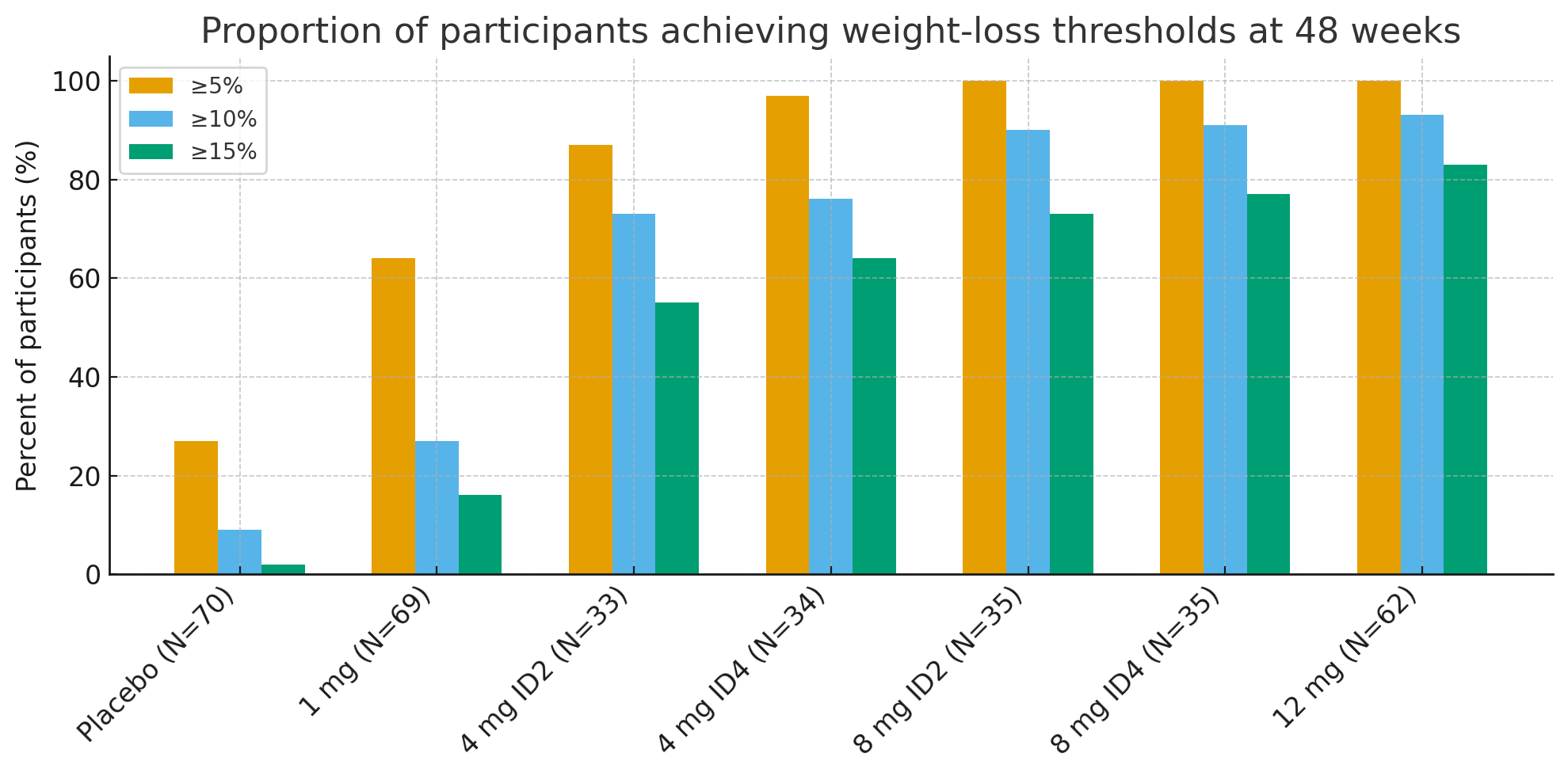
48 週目に、臨床的に意味のある体重減少の閾値を達成した参加者の割合は顕著でした。
-
5%以上の体重減少:プラセボ群では27%、実薬群では92~100%
-
≥10%: プラセボ群9% vs. 実薬群73~93%
-
≥15%: プラセボ群2%に対し、実薬群55~83%
12mg群では、最大参加者の26%がベースラインの体重の30%以上を減らした減量の規模は肥満手術に匹敵します。
安全性
最も多くみられた有害事象は消化器系(吐き気、嘔吐、下痢)で、概ね軽度から中等度で、用量依存性がありました。開始用量を低く設定(2mgの漸増投与)することで、これらの事象は減少しました。用量依存性の心拍数増加が認められ、24週目にピークに達し、その後減少しました。投与中止率は実薬群全体で6~16%で、プラセボ群よりもやや高くなりました。
結論
糖尿病のない肥満成人において、48週間の週1回の皮下投与で、用量依存的に体重が大幅に減少する(最高用量では平均約24%の減少)、心血管代謝マーカーの改善も認められました。消化器系の有害事象は頻繁に発生しましたが、漸増投与により管理可能でした。これらの第2相試験の結果は、レタトルチドが肥満治療の新たなベンチマークとなる可能性を示唆しており、より大規模で長期的な第3相試験での確認が待たれます。
投稿日時: 2025年9月28日